Novità: la Marcatura UKCA per i dispositivi medici
La marcatura UKCA è entrata in vigore in Gran Bretagna nel gennaio 2021, quando il Regno Unito ha lasciato l'Unione Europea. La certificazione UKCA può essere richiesta per alcune classificazioni di dispositivi medici ed è disponibile presso gli organismi approvati, come BSI (0086), nominati nel Regno Unito. È previsto un periodo di transizione fino al 30 giugno 2023 per consentire la sostituzione delle certificazioni CE esistenti con il nuovo marchio UKCA. Tuttavia, la consultazione per la nuova legislazione britannica è terminata; pertanto, la nuova legislazione britannica dovrebbe essere pubblicata entro la fine dell'anno.
Dal 1° gennaio 2021, i dispositivi medici/IVD devono essere registrati presso l'MHRA prima di essere immessi sul mercato del Regno Unito, indipendentemente dal fatto che siano marcati UKCA o CE. I periodi di grazia per la registrazione dei dispositivi in base alla loro classe di rischio sono ormai scaduti. Pertanto, è obbligatorio registrare tutti i dispositivi con MHRA prima di immetterli sul mercato.
Per l'Irlanda del Nord, i regolamenti MDR e IVDR dell'UE si applicano rispettivamente dal 26 maggio 2021 e dal 26 maggio 2022. Anche dopo il 1° luglio 2023, il marchio CE continuerà a essere richiesto per i dispositivi immessi sul mercato dell'Irlanda del Nord e i produttori dovranno soddisfare le normative dell'UE.
In questa comunicazione vogliamo chiarire alcuni altri aspetti dell'UKCA. In primo luogo, fai riferimento al nostro documento dettagliato delle FAQ online, che copre molte domande che potresti avere su UKCA.
- Etichettatura e requisiti IFU per la marcatura UKCA
È fondamentale assicurarsi che l'etichettatura e le istruzioni per l'uso siano state aggiornate per fare riferimento al marchio UKCA, se pertinente. Le considerazioni primarie per quest'area includono
- L'etichettatura deve fare riferimento al marchio UKCA, compreso il numero dell'organismo approvato, ad esempio BSI (0086), se un organismo approvato è stato coinvolto nel processo di valutazione della conformità
- I dispositivi possono avere sia la marcatura CE che quella UKCA presenti sull'etichetta prima del 1° luglio 2023 e la doppia marcatura continuerà ad essere accettata sul mercato della Gran Bretagna dopo il 1° luglio 2023.
- Persona responsabile del Regno Unito
Se il produttore ha sede al di fuori del Regno Unito, deve essere nominato un UK Responsible Person (UKRP). Questo è un requisito obbligatorio per tutti i prodotti con marchio UKCA o CE per produttori non britannici. Fare riferimento ai requisiti MHRA per UKRP.
- Dichiarazione di conformità (DoC) richiesta per la marcatura UKCA
Nei casi in cui è stato apposto il marchio UKCA (anche quando i dispositivi sono stati contrassegnati doppiamente), la tua DoC deve essere aggiornata per il marchio UKCA. Il DoC dovrebbe fare riferimento ai requisiti legislativi del Regno Unito, compresi i riferimenti; la normativa corretta è il Regolamento Dispositivi Medici 2002 (SI618) come successivamente modificato dai Regolamenti di Uscita UE del 2019 (SI 791) e del 2020 (SI 1478).
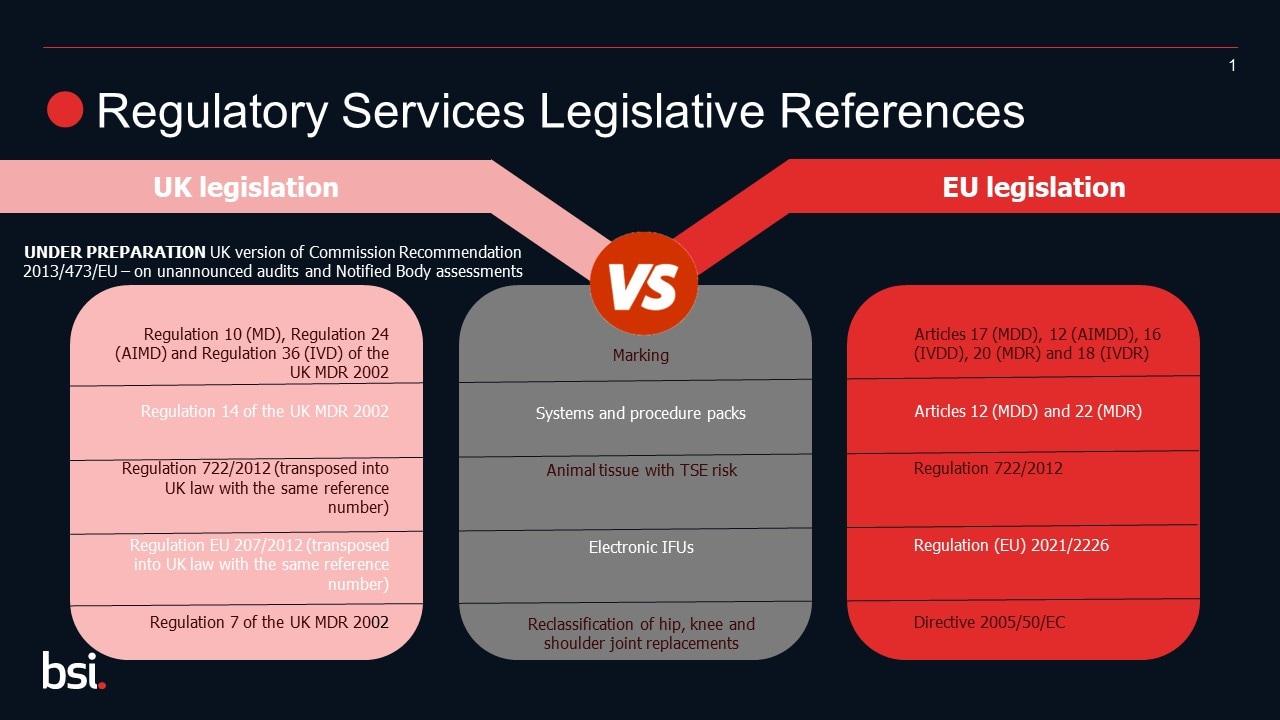
- Legislazione orizzontale del Regno Unito e standard designati
I riferimenti alla legislazione orizzontale sono cambiati nell'ambito dell'UKCA; si prega di fare riferimento al diagramma per valutare le vostre esigenze.
Inoltre, quando il Regno Unito ha lasciato l'UE, il legame con le norme armonizzate pubblicate nella Gazzetta ufficiale dell'UE è stato interrotto. Di conseguenza, il Regno Unito ha pubblicato il proprio elenco di standard che supportano la regolamentazione del Regno Unito. Questi sono stati definiti "standard designati".
I fabbricanti che utilizzano standard per supportare la conformità dei loro dispositivi dovrebbero essere consapevoli della pubblicazione degli elenchi del Regno Unito di standard designati e monitorare ulteriori informazioni sulla manutenzione di questi elenchi.
Cosa devo fare ora?
La marcatura CE cesserà di essere accettata per il mercato del Regno Unito dopo giugno 2023 e la marcatura UKCA diventerà obbligatoria da luglio 2023. Pertanto, assicurati che le tue comunicazioni contengano informazioni aggiornate in modo da non causare ritardi indebiti nelle revisioni.
BSI desidera chiederti informazioni sui tuoi piani attuali per consentirci di assegnare la capacità tecnica richiesta. Per favore, potresti dedicare 10 minuti a completare il nostro sondaggio per supportare la nostra pianificazione delle risorse come organismo approvato dall'UKCA?
Parlaci dei tuoi piani UKCA completando questo breve questionario.
Si prega di completare questo entro venerdì 1 aprile 2022.
A chi posso rivolgermi per ulteriori informazioni?
Il 27 aprile organizzeremo un webinar per condividere gli ultimi aggiornamenti; per favore, unisciti a noi dal vivo.
In caso di domande o dubbi, fare riferimento in primo luogo al sito Web BSI, dove conserviamo informazioni aggiornate sulla certificazione UKCA. Se necessario, è possibile fornire ulteriori informazioni tramite il gestore dello schema BSI.
Cordialmente
Vishal Thakker
Head of UK Approved Body,
Regulatory Services (Medical Devices)


